铜和稀盐酸反应的化学方程式
铜和稀盐酸反应的化学方程式
铜是生活中常见的金属,被人们广泛应用,也是中学化学重点学习的金属之一。

一、铜的物理性质
铜(化学符号:Cu)是紫红色的金属、延展性好。
导电性:铜的导电性良好,广泛应用于电缆线。金属的导电性大小:银>铜>金>铝>铁>钢。高压电线的材质为什么是铝而不是铜?
1、铝价格便宜
2、铝的密度较小,质量较轻。减轻了电线塔的承载能力。
3、铝的导电能力比铜略差。
4、铝抗氧化能力比铜强,比铜经久耐用。

铜的密度:8.92g/cm3,密度较大。常见金属的密度大小:金>汞>铅>银>铜>铁>铝>镁。青铜:青铜是铜(Cu)与锡(Sn)的合金,与纯铜相比,青铜的硬度高,熔点低。青铜应用:青铜剑、酒器、铜镜等。

黄铜:黄铜是铜(Cu)与锌(Zn)的合金,黄铜有较强的耐磨性,黄铜用于制造阀门、水管、空调内外机连接管等。

二、铜的化学性质
1、在加热时,红色的铜与空气中的氧气反应生成黑色的氧化铜固体(化学式:CuO)。

铜与氧气在加热条件下生产氧化铜的文字表达式与化学方程式

2、铜与氧气、二氧碳与水反应生成碱式碳酸铜(俗称铜绿或铜锈)
碱式碳酸铜(化学式:Cu2(OH)2CO3):呈孔雀绿色的粉末状固体,溶于酸,受热分解成氧化铜、二氧化碳和水。

碱式碳酸铜加热分解实验
2.1、实验原理
碱式碳酸铜在加热的条件下生成氧化铜、二氧化碳和水
2.2、实验器材
试管、酒精灯、铁架台、导管、烧杯、单孔塞
药品:碱式碳酸铜
2.3、实验步骤
1、组装好设备:按自下往上,从左向右的顺序进行组装。
先放铁架台→放酒精灯→安装试管→安装导管→放置烧杯

注意:
酒精灯与试管底部之间的距离,要用外焰加热; 试管口要略向下倾斜,防止加热时,试管口处冷凝水回流到试管底部,造成试管炸裂; 夹子夹在试管的中上部,离试管口约1/3处; 导管伸入试管不能太长,太长不利于气体导出。
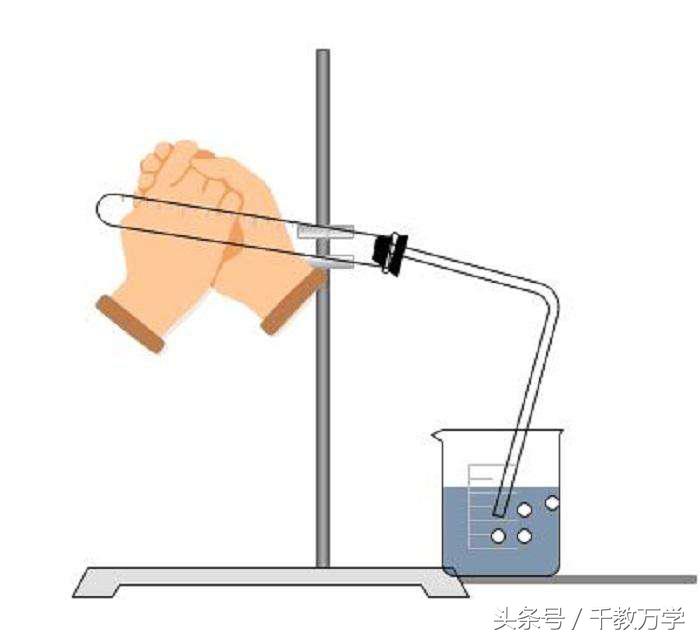
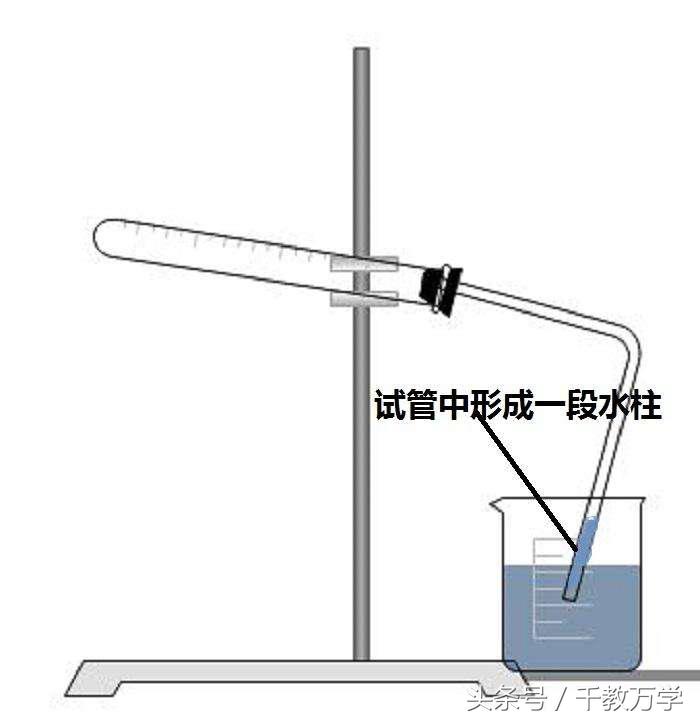
2、气密性检验(热胀冷缩法或微热法)
组装好设备如图,要构成密闭系统,导管一端放入烧杯液面以下,试管塞要塞紧,然后用手捂住试管,观察烧杯中试管口处有气泡冒出,松开手,水会倒流入导管口内,形成一段水柱,说明气密性良好。
3、放入药品
用钥匙从药瓶中取出碱式碳酸铜粉末(或用纸槽)伸入试管,将样品放入试管底部,且药品要均匀铺设在试管底部,再塞进试管塞。将导管的另一端伸入澄清石灰水的烧杯中。
4、加热
点燃酒精灯,在试管的底部或中部之间来回加热4~5次进行预热,然后再用外焰集中对固体进行加热。 观察烧杯中的澄清石灰水变浊。


5、反应完成后,先移走导管,再停止加热。
为什么先移走导管,再熄灭酒精灯?
答:如果先移走酒精灯,导管会变冷,导管的气压降低,烧杯中的水会顺着导管倒吸到试管中,导致试管炸裂。
6、实验现象:

试管中固体的颜色由绿色逐渐变成黑色(黑色物质为氧化铜); 烧杯中有气泡冒出; 烧杯中澄清石灰水变浑浊(有二氧化碳生成); 试管口处有小水滴产生(有水蒸气生成)。
总结:碱式碳酸铜加热生成二氧化碳、水和氧化铜,可证明碱式碳酸铜中含有氧、碳、氢、铜元素。
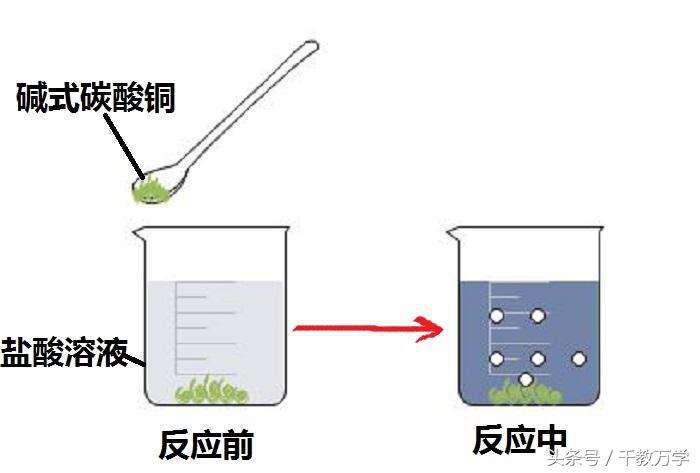
三、碱式碳酸铜与盐酸反应生成:水、二氧化碳、氯化铜。
现象:有气泡产生、溶液有无色变成蓝色。如图:
标签: